Perhitungan Kimia
(Stoikiometri)
Teman-teman pada saat
menimbang gula tentunya kalian tidak akan enghitung banyaknya gula pasir,
bukan? Banyaknya gula pasir tidak dihitung berdasarkan banyaknya butiran gula,
tetapi berdasarkan massanya, misalkan 1 kg.
Demikian halnya dengan
atom, molekul, dan ion. Karena ukurannya sengat kecil, jumlah penentuan atom,
molekul, dan ion dilakukan dengan cara menghitung jumlah partikel yang ada.
Perhitungan ini sering disebut perhitungan kimia.
1.
Mol
Mol
adalah satuan yang digunakan untuk menyatakan jumlah suatu atom, molekul,
ataupun ion.
“satu
mol adalah jumlah partikel yang terkandung dalam suatu zat yang jumlahnya sama
dengan partikel yang terdapat dalam 12 gram atom C-12.”
Banyak
etom yang terdapat dalam 12 gram C-12 adalah 6,02x1023 partikel yang
disebut dengan tetapan Avogadro dan dinyatakan dengan huruf L (awalan nama
Loschmid).
Dalam
ketentuan tersebut, partikel dapat berupa atom, molekul, maupun ion. Jumlah
partikel suatu zat (x) bergantung pada jumlah mol (n) zat tersebut.
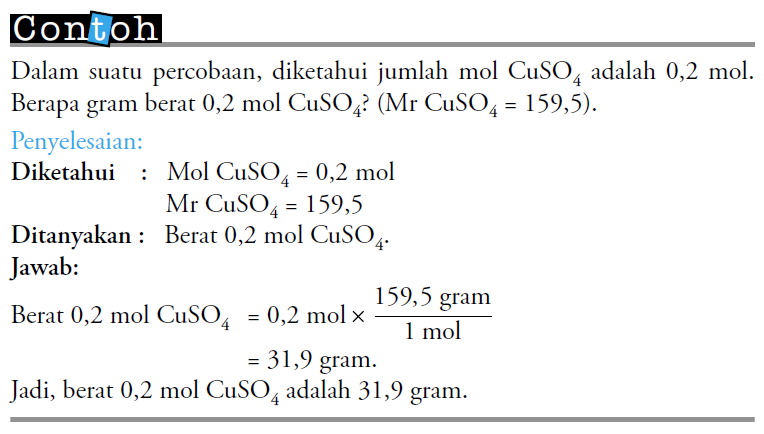
Nah,
supaya teman-teman lebih memahami penjelasan diatas, perhatikan contoh berikut.
2.
Massa
Molar
Massa
11 mol zat sering disebut massa molar. Massa molar berkaitan dengan Ar atau Mr
dari suatu zat. Nah sekarang bagaimana cara menghitung massa molar zat?
Perhatikan contoh berikut!
Dengan
memahami contoh diatas, kalian mengatahua bahwa:
-
Massa
molar untuk partikel yang berupa atom =
Ar gram mol-1
-
Massa
molar untuk partikel yang berupa molekul = Mr gram mol-1
Perhatikan contoh berikut!
3.
Volum Molar
Volume
molar adalah volume suatu mol zat yang berwujud gas.
Volume
gas dipengaruhi oleh suhu dan tekanan, sehingga untuk menentukan volume gas,
kita harus mengetahui suhu (T) dan tekanan (P) gas tersebut. Kondisi suhu 0OC
dan tekanan 1 atm disebut keadaan standar (Standard Temperature and Pressure
atau STP).
“pada suhu 0OC dan tekanan 1 atm
(STP), volume 1 mol setiap gas adalah = 22,4 Liter (volum molar gas”
Untuk
menghitung volume (V) suatu gas pada suhu 0OC dan tekanan 1 atm
(STP), kita harus mengalikan jumlah mol (n) dengan volume molar (Vm). Ditulis:
Perhatikan
contoh berikut!
Sekarag
teman-teman sudah mengetahui hubungan volume molar gas, massa molar, dan jumlah
mol dari suatu senyawa. Agar lebih menguasai cara perhitungan volume zat,
pahamilah bagan berikut.
Lalu
bagaiman menggunakan pola hubungan diatas? Pahami contoh sola berikut.
4.
Menentukan
Rumus Empiris dan Rumus Molekul
Ruus
empiris menunjukan perbandingan jumlah atom-atom penyusun yang dinyatakan dalam
bilangan bulat positif.
Sementara
itu, rumus molekul menunjukan jumlah atom-atom dalam senyawa dan merupakan
kelipatan dari rumus empiris.
Perhatikan
satu contoh soal lagi.
Nah, untuk soal-soal dan pembahannya bisa teman-teman lihat di Label 10 Soal dan Pembahasan Kimia tentang Perhitungan Kimia (Stoikiometri).. selamat belajar..





















2 komentar:
gimana hasilnya kalo buah semangka di reaksikan dengan gula? apakah berbahaya atau tidak? kalo berbahaya alasannya apa kalo tidak alasannya apa, so'alnya saya denger dari temen saya kalo buah semangka di reaksikan sama gulaakan bersifat racun, tapi saya kurang percaya, mohon jawabannya di kirim ke email saya di rosidin.92@gmail.com. terimakasih
maaf baru saya balas..
penambahan gula putih ke buah-buahan misalnya semangka yang mengandung gula dan banyak mengandung air hanya akan menyebabkan fluktuasi gula darah bila dikonsumsi dan penambahan gula pada semangka akan mengurangi nilai gizinya. tentunya bila dikonsumsi berlebihan akan berbahaya bagi tubuh kita.
Posting Komentar